喜报 | 科标医学参与制定的国家标准下月实施
 2024年06月03日 |
2024年06月03日 | 阅读次数:372
阅读次数:372喜 报 GOOD NEWS 由科标医学参与起草的《医疗器械临床前动物研究 第3部分:用于评价补片组织学反应与生物力学性能的动物腹壁切口疝模型》(YY/T 1754.3-2023)于2023年6月20日正式发布,2024年7月1日实施。于2023年6月20日正式发布,2024年7月1日实施。 YY/T 1754旨在建立医疗器械临床前动物研究的具体试验方法,拟由3个部分构成。 -第1部分:通用要求。目的在于给出医疗器械临床前动物研究的通用要求。 -第2部分:诱导糖尿病大鼠皮肤缺损模型。目的在于给出诱导糖尿病大鼠皮肤缺损模型的构建方法。 -第3部分:用于评价补片组织学反应与生物力学性能的动物腹壁切口疝模型。目的在于给出腹腔内置补片组织学反应与生物力学性能的测试与评价方法。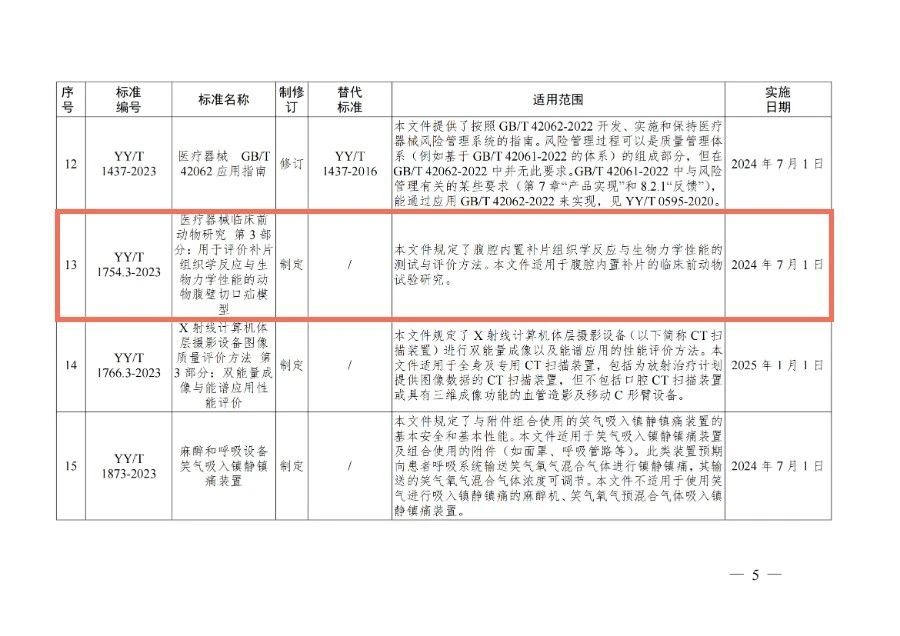


新标准的出台实施,标志着我国在医疗器械临床前动物研究领域取得了新的突破,对于提升医疗器械的安全性和有效性具有重要意义。 该标准的起草过程中,科标医学充分发挥了其在医疗器械领域的專業优势,结合多年的研究经验和丰富的实践数据,为标准的制定提供了有力的支撑。此外,科标医学在起草该标准的过程中,还积极借鉴了國際先进经验和技术,结合国内实际情况进行了创新和完善。这使得该标准不仅符合国内医疗器械行业的发展需求,也具备了一定的國際竞争力,为我国医疗器械行业的國際化发展提供了有力支持。 展望未来,科标医学将继续关注行业动态以及行业标准的发展趋势,不断推动医疗器械临床前动物研究的深入发展。同时,科标医学还将加强与国内外同行的交流与合作,共同推动医疗器械行业的技术创新和产品升级,持续完善医疗器械检测与创新研究服务平台,为医疗器械研发不断注入创新动力,提供更强更有力的技术服务支撑!
科标医学 江苏科标医学技术集团有限公司是专注服务医疗器械、器械材料、化妆品、xiao毒产品、包装材料生产企业的專業检测机构,实验室具备CNAS、CMA资质,符合FDA的GLP要求。我们的服务以动物、微生物、物理、化学为基础,植入、介入产品为特色,可提供产品的安全性与功效性评价,以及各类净化设施的监测、验证和测试服务。 我们拥有国内先进的技术水平,和经验丰富的技术專家团队,具备優秀的技术服务能力,目前,已累计服务超5000家企业,所出具的检测报告均符合医疗器械国内注册,CE注册,FDA注册法规要求. 服务内容涵盖 ✓ 生物学评价与试验 ✓ 临床前大动物试验 ✓ 化学分析 ✓ 毒理学评估 ✓ 微生物检测 ✓ 洁净室检测及设施验证 ✓ 包装验证 ✓ 医疗器械创新研究服务 ✓ 眼科科研服务








