ISO 10993-4:2017 血液相容性测试标准解读
 2020年06月08日 |
2020年06月08日 | 阅读次数:633
阅读次数:633ISO 10993-4:2017 血液相容性测试标准解读
凡是与人体循环血有直接或间接接触的医疗器械,如果没有足够的数据证明其满足血液相容性要求,那么都要开展血液相容性测试。其中,ISO 10993-4:2017是医疗器械血液相容性测试的重要参考标准,今天科标医学就和大家一起解读该标准要求,了解测试的来龙去脉。
血液相容性测试,主要用来评估与血液接触的医疗器械、或用于血液或血液制品材料的影响。在选择和制订测试方案时,要将产品设计、临床使用、使用环境和风险收益等因素纳入考虑。
作为血液相容性测试的重要参考标准,ISO 10993-4:2017主要包含三块内容:1)与血液接触医疗器械的分类情况;2)评估血液反应的基本特性;3)测试方法的选择。
1. 非血液接触器械
Non-blood-contact devices(非血液接触器械),并不是不和血液接触的器械,而是指代,不与留在或重新输回体内的血液或血液成分有直接或间接接触的器械,例如,体外诊断试剂和血液采集管。
2. 外部连通器械
External communicating devices(外部连通器械)通常会和循环血接触,并且会接入人体血管系统。那么,具体会包含哪些产品呢?下表整理了常见的三类外部连通器械,并列举了相关实例供大家理解。
编号 | 类别 | 常见器械 |
1 | 间接血路 | 血液收集装置、插管、细胞收集装置、血液和血液产品的储存和输送装置(如血袋和输血管)、延伸装置(与静脉输液配套使用)、血管内医用导管 |
2 | 直接接触循环血 | 粥样斑块切除装置、直接或间接血液接触的血液监测装置、心肺旁路电路、吸附血液中特定物质的装置、治疗性血液分离设备、体外膜式氧合器、血液透析/血液过滤装置、心脏和血管介入装置、血管内导管(如配合使用气囊、成像、激光、超声)、白细胞去除过滤器、经皮循环支持装置、逆行冠状动脉灌注导管、血管导丝 |
3 | 植入器械 | 瓣膜成形环、动静脉分流器、血液监测仪(植入式)、循环支持装置(如心室辅助装置、人造心脏、主动脉内球囊泵)、栓塞装置、血管内合成血管移植物、植入式除颤器和复律器导管、下腔静脉过滤器、体内给药导管、血管内氧合器(如人工肺)、机械或组织心脏瓣膜、心脏起搏器导管、手术合成或组织血管移植物、血管支架 |
在明确器械种类后,就要了解产品的血液反应特性,其核心目的是为了选择合适的测试方法。在本章内容中,有两个关键点,大家需要特别注意:1)首先,本标准提供了决策流程图,能够帮大家理清是否需要开展血液相容性测试;2)同时,本标准列举了与循环血接触的器械实例,以及对应的测试类别。
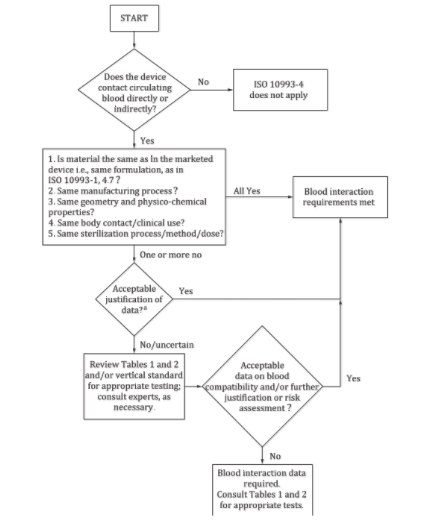
决策流程图
通过回答下面四个问题,大家可以初步判断自己的产品是否需要开展血液相容性测试。1)问题一:器械是否直接或间接接触循环血?如果不是,则本标准不适用;如果是,则回答问题二;2)问题二:器械用到的材料是否和上市产品的材料一致?是否经历相同的加工过程?是否具备同样的结构和理化性质?是否与人体接触?是否具备同样的临床使用方法?是否经历灭菌过程,用到的方法和剂量是否相同?如果全是,则满足血液反应要求,无需开展测试;如果有一条及以上不符合,则回答问题三;3)问题三:对于差异部分进行评估,判断数据是否可接受?如果是,则无需开展测试;如果不是或不确定,则继续评估表格1和2内容,或参考相关垂直标准,或咨询专业人士,进而回答问题四;4)问题四:进一步判断或评估风险,血液相容性数据是否可接受?如果是,则无需开展测试;如果不是,则要按照表格1和2,开展血液相容性测试。
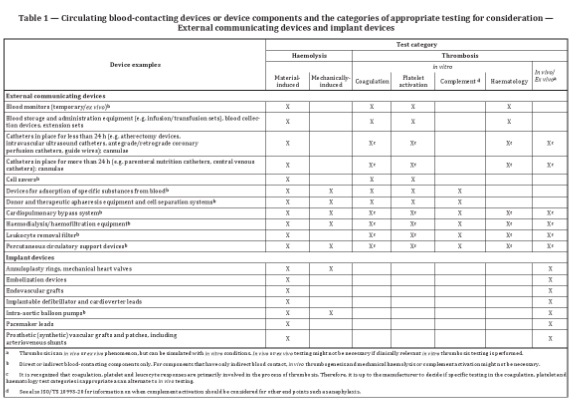
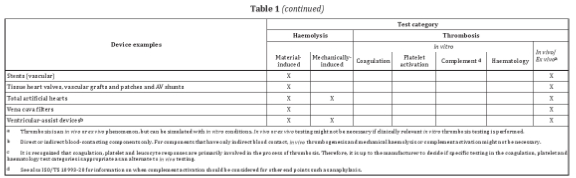
常见器械及对应测试类别
针对外部连通器械和植入器械,表格1列举了与循环血接触的常见器械或器械组分,并提供了可参考的测试类别。例如血液监测装置,可考虑的测试包括:材料介导的红血球溶解实验,体外凝血、血小板激活及血液学实验。
如果明确了测试类别后,接下来,厂商要考虑的就是产品的血液反应特性。具体而言,与之相关的参数包括:产品的结构形状、材料理化性质、表面特性和灭菌条件,产品接触时长和环境温度,以及抗凝和血液流动条件等。如果要进行动物研究,例如植入产品,则要尽可能贴近临床使用情况。当然,这么多参数不一定都要纳入考虑范围,厂商要根据产品特性,特别是要基于已有的研究或文献资料,选择重药关注的特性参数。
一般而言,标准推荐的血液相容性测试可以分为两大类:1)溶血试验:包括材料介导和机械介导;2)血栓试验:体外实验包括凝血、血小板激活、补体激活和血液学试验,另外还包括直接体内实验(In vivo tests)和间接体内实验(Ex vivo tests)。详见表格2。
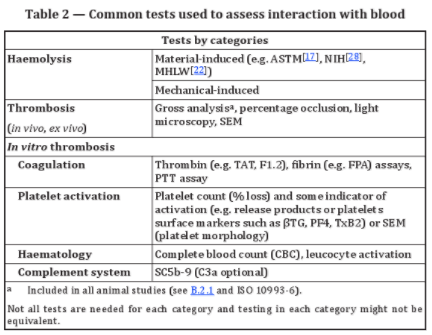
具体来说:
如果开展体外试验(in vitro tests),通常要考虑的试验变量有:血细胞比容、抗凝血剂(类型和用量)、血液/血液成分年龄、样品制备、样品表面积与血容量的比值、样品储存、温度、pH、流体流动条件(如流速、贴壁剪切力和速率)等。
另外,如果器械的预期用途是离体使用,如血液透析装置,那么离体试验(ex vivo tests)就必不可少了。通过离体测试系统,可以监测血小板粘附、血栓形成、纤维蛋白原沉积、白细胞粘附、血小板活化等现象。其中,血流速率可以由多普勒或电磁流量探头实时测量,流速的改变可以显示血栓沉积和栓塞形成。
如果是涉及植入器械(比如血管支架和心脏瓣膜)的体内动物试验,要尽可能贴近临床使用情况。通常,会将“导管或装置的通畅度(即通过装置的非闭塞血流)”作为体内试验的重要评价指标。此外,在移除装置后,也会对植入器械周围组织和器官病理学进行评估。当然,厂商可以根据产品特点和实际需求,使用额外的评估方法,比如血管造影、血管内超声(IVUS)等技术。
ISO 10993-4:2017通读下来,对于与血液接触的医疗器械分类情况、血液反应的基本特性以及常用测试方法,做了简单介绍。但关于试验方案设计以及具体的测试要求,例如如何开展体内血栓、体外溶血、血小板激活等试验,本文并未做详细说明,若有需要的话,大家可以参考附录A-G。
参考资料:
[1] ISO 10993-4:2017 Biological evaluation of medical devices -- Part 4: Selection of tests for interactions with blood








